单克隆抗体(mAbs)的功能与其结构密切相关。抗体结合区域(antigen-binding fragment, Fab)能够特异地识别肿瘤相关抗原(tumor-associated antigen, TAA),从而调控TAA相关的下游信号通路[2]。可结晶区域(crystalline fragment, Fc)能够和表达在各类免疫白细胞上的Fcγ受体(Fcγ receptors,FcγR) 结合,从而招募和激活这类细胞,引发抗体依赖的细胞毒性作用(ADCC)和抗体依赖细胞介导的吞噬作用(ADCP),清除目标肿瘤细胞。Fc也能够结合血清补体分子(C1q),继而形成膜攻击复合物(MAC)清除目的细胞,即补体依赖的细胞毒性(CDC)。此外,Fc还能够以pH依赖的方式结合新生的Fc受体(FcγRn),避免抗体被细胞降解,从而延长单抗的半衰期[1-3]。
同一抗体的Fab区和Fc区的氨基酸组成和顺序的不同,其功能上也存在很大差异。不同抗体的Fc区在结构变化上具有一定的规律,又使得其在功能上存在共性。IgG家族包含四个成员,IgG1-4,它们有着不同的铰链区,在Fc区域上也存在一些氨基酸的差异。它们与FcγR的亲和力各不相同,因此功能上也有差异[4,5]。通过IgG氨基酸突变,可以调整其与FcγR的结合,平衡Fc片段介导的效应功能,从而满足不同单抗功效的需求[6]。比如,通过抗体Fc区域改造,增强Fc与巨噬细胞上的FcγRIIa以及NK细胞上FcγRIIIa的结合,能够更有效地对这些细胞进行招募,从而对肿瘤细胞进行杀伤;提高Fc与FcγRIIb的亲和力来增强免疫抑制作用,因此可用于自身免疫以及过敏原的清除;增强Fc与FcRn的结合能够延长单抗药在体内的半衰期[3,7]。
在已批准的单抗中,绝大部分都是使用的未经改造的IgG1亚型。针对mAbs的氨基酸序列、分子构象、亚基类型等进行设计,使mAbs能够发挥一系列效应功能,如ADCC、ADCP和CDC等,进而提升单抗的功效,是未来新型抗体研发的重要方向。
安泰吉公司是抗体研发技术的专业公司,有着丰富的抗体设计经验,能够针对抗体的不同效应机制为您定制化设计抗体分子,从而解决各种抗体的表达瓶颈,包括ScFv-Ig、bispecific antibody、trifunctional antibody、Fc 融合蛋白等,为您的药物开发增砖添瓦。
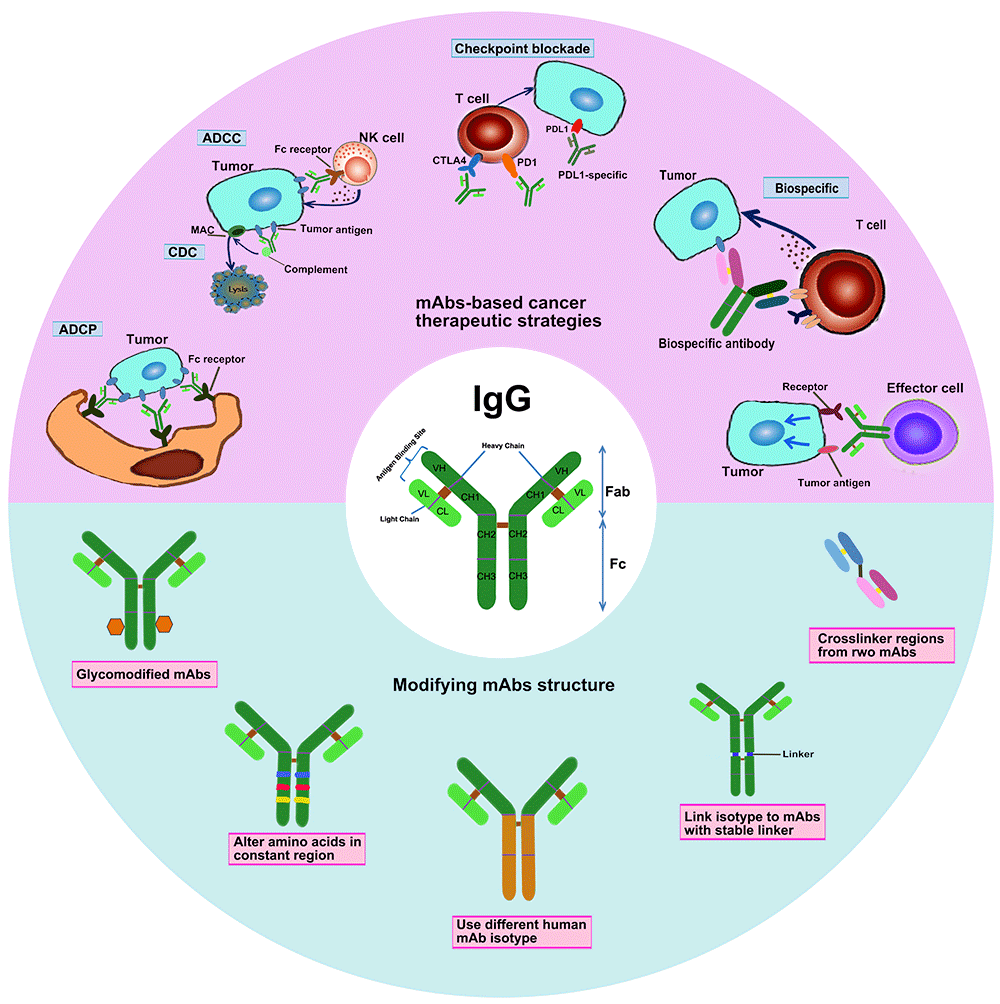
图1 基于mAbs的癌症治疗策略以及mAbs抗体设计和改造
参考文献:







